Natriumchlorid – ein Salz

Sprechen wir von Salz, so meinen wir im täglichen Sprachgebrauch fast immer Speise– oder Kochsalz. Natriumchlorid heißt dieses Salz in der Chemie. Es ist das Natriumsalz der Salzsäure oder Chlorwasserstoffsäure.
Seine Formel lautet NaCl, es bildet farblose, feste würfelförmige Kristalle, die uns weiß erscheinen, wenn sie durch Zerkleinern Risse beinhalten.
Kochsalz löst sich gut in Wasser (36g/100ml), ist geruchlos und nicht brennbar.
Wir benötigen ca. 5g Salz am Tag. Wir nutzen Salz zum Würzen unserer Speisen, zur Konservierung von Nahrung und auch zur Enteisung von Straßen im Winter. In medizinischen Präparaten dient es als 0,7% Lösung als kurzzeitiger Blutersatz zur Kreislaufstabilisierung.





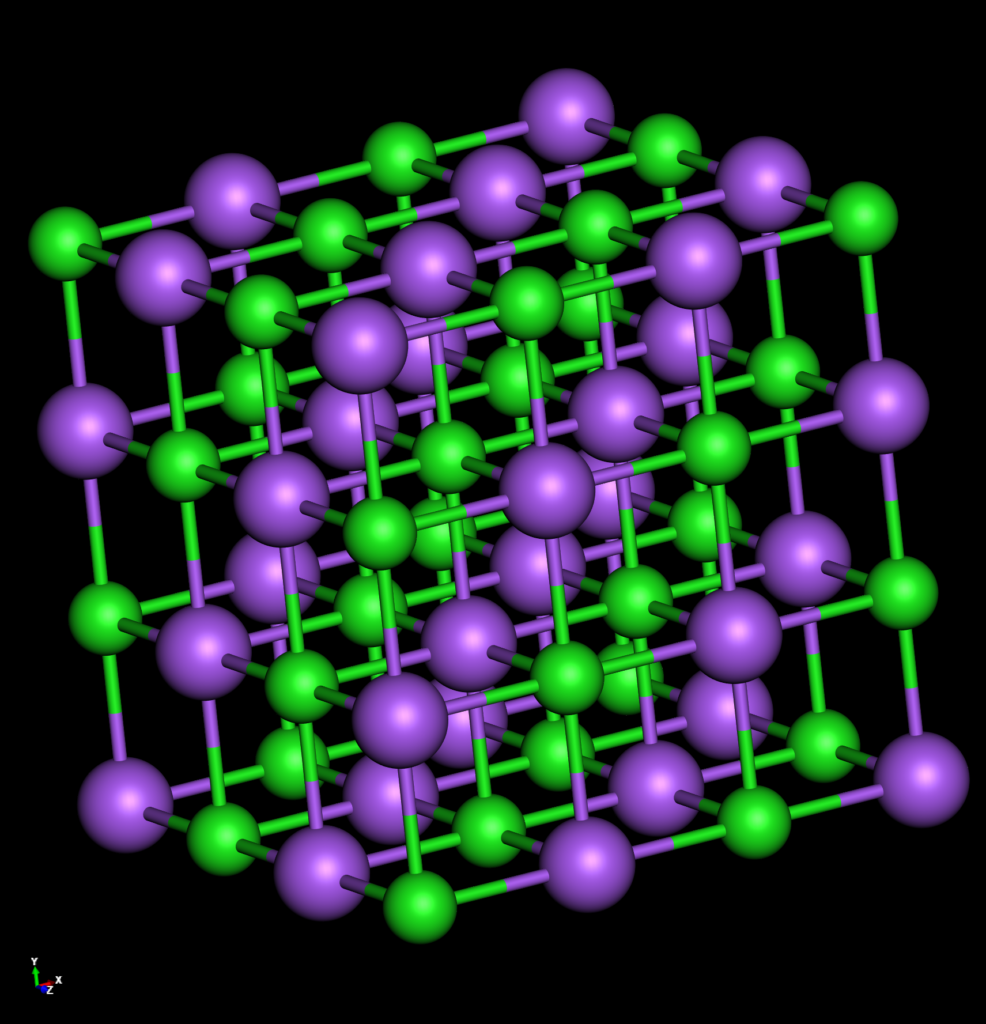
Der Bau von Salz
Salz bildet einen Ionenkristall. Seine Bestandteile sind die Ionen der Elemente Natrium und Chlor. Das positiv geladene Natriumion ist in allen Richtungen (rechts, links, vorn, hinten, oben, unten) von negativ geladenen Chloridionen umgeben. Die Ionen halten durch die vorhandenen Anziehungskräfte (positiv/negativ) und die nebenbei auch entstehenden Abstoßungskräfte einen konstanten Abstand zueinander. Das Mineral NaCl heißt „Halit“ (engl. Halite). und bildet würfelförmige Kristalle, die farblos sind.
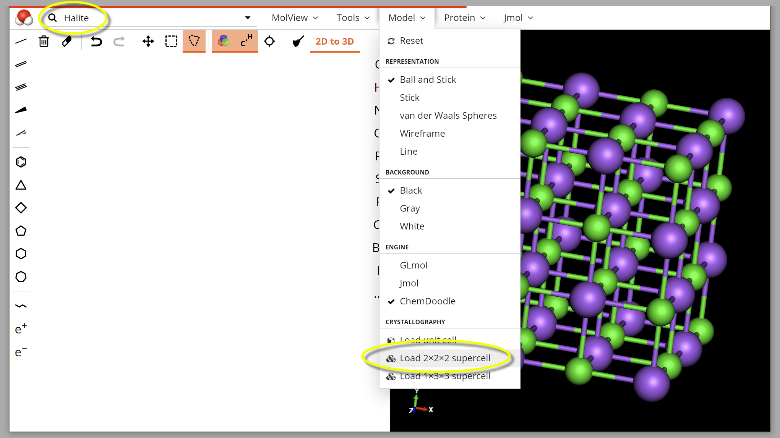
Für eine animierte Version dieser Darstellung gehen Sie folgendermaßen vor:
Geben Sie auf www.molview.org in die Suchzeile „Halite“ein und stellen Sie unter „Model“ die „2x2x2 Celle“ aus.
Das Auflösen von Salz im Wasser
►als Video , Salz lösen (von www.chemie-interaktiv.net)
Wassermoleküle sind ständig in Bewegung. Sie sind sogenannte Dipole. Das bedeutet, ihre Moleküle besitzen positive und negative Ladungsschwerpunkte, die Anziehungskraft auf entgegengesetzt geladene Teilchen ausüben. Das macht Wasser zu einem hervorragenden Lösungsmittel.
Und das immer nach dem gleichen Schema:
1. Die Wassermoleküle dringen in den Ionenkristall ein.
2. Die Kräfte zwischen den Ionen im Gitter werden durch die Ladungs- und Abstandsveränderungen geschwächt.
3. Die Wassermoleküle umlagern die Ionen.
4. Die umlagerten Ionen werden – dank der Eigenbewegung von Wasser- abtransportiert.
Dieser Prozess verläuft endotherm:
Der folgende Inhalt stammt von www.javalab.org
Der „Eis- Salz – Wasser“ Kühlschrank:
Experiment zu „Salze im Lösungsprozessen“ – mit Deutung der Ergebnisse
Arbeitsblätter zum Thema Salz auch im Arbeitsmaterial Klasse 9 :




mehr zum Thema Salz:
Lernprogramm Salz (PC – Download)
Lernbox Salz der Uni Bremen ( Chemie Didaktik )
![]()
Müll sortieren
Mehr davon… Version 2
![]()
Laborgeräte Übungen
Diese Übung stammt von A. Spielhoff, https://apps.zum.de/apps/laborgeraete
weitere Übungen:
Laborgeräte – zuordnen
Laborgeräte – zuordnen
Laborgeräte benennen(schreiben) / zuordnen
Laborgeräte – Quiz – (multiple choice)
![]()
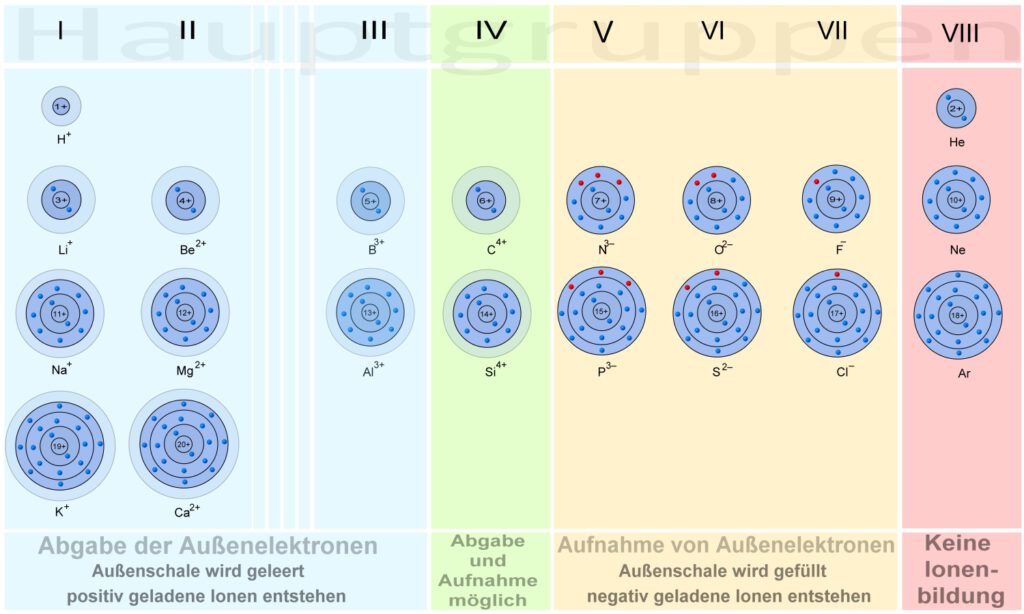
Ionenbildung
Nur wenige Elemente (Atomarten) stellen die stabilsten Zustände dar, die Edelgase. Die Edelgase sind reaktionsträge und wir finden sie nicht in Verbindungen vor. Alle anderen Elemente sind bereit, bei kleinster Beeinflussung in diese sogenannten „Edelgaszustände“ überzugehen.
Alle Atome streben nach dem Zustand, eine voll besetzte Außenschale zu besitzen.
Die Elemente bilden ihre Ionen durch die Aufnahme fremder Elektronen in ihre Außenschale oder die Abgabe von eigenen Elektronen aus ihrer Außenschale.
Beispiel: Natrium (Element 11, 1. Hauptgruppe im PSE)
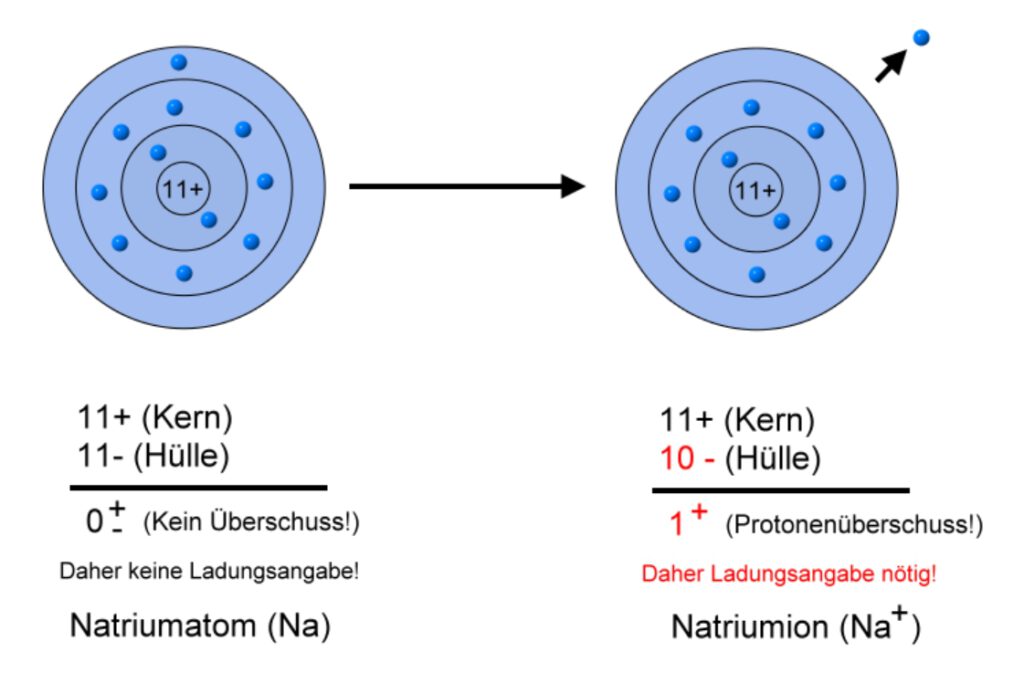
\( Na \rightarrow Na^+ + e^- \)
Das Natriumatom hat ein Außenelektron. Um eine volle Außenschale zu haben, müsste es entweder 7 Elektronen aufnehmen oder aber sein einziges Außenelektron abgeben. Der Weg des geringeren Widerstandes (Aufwandes) wird häufiger gegangen und so neigt das Natriumatom zur Elektronenabgabe. Auch im Kochsalz liegt es in seiner Ionenform \( (Na^+) \) vor.
Beispiel: Fluor (Element 9, 7. Hauptgruppe im PSE)
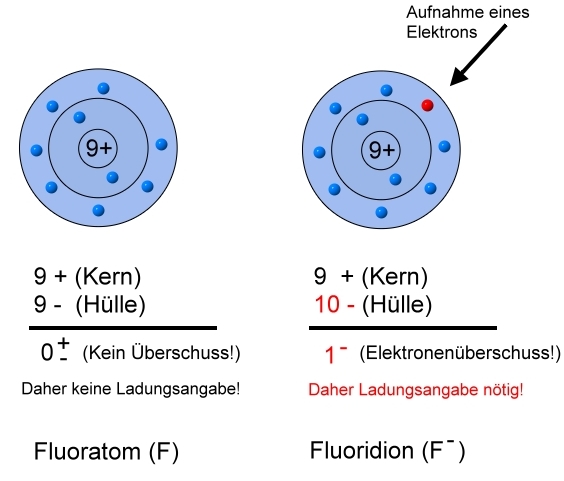
\( F + e^- \rightarrow F^- \)
Das Fluoratom hat 7 Außenelektronen. Um eine volle Außenschale zu haben, müsste es entweder die 7 Elektronen abgeben oder aber ein einziges Außenelektron aufnehmen. Auch hier wird der Weg des geringeren Widerstandes (Aufwandes) eingeschlagen und so findet man bevorzugt das Fluoridion \( (F^-) \) in der Natur.
(Sauerstofffreie Nichtmetallionen bekommen alle die Endung „id“ angehangen. Mit steigendem Sauerstoffgehalt eines Ions ändern sich die Endungen systematisch.)
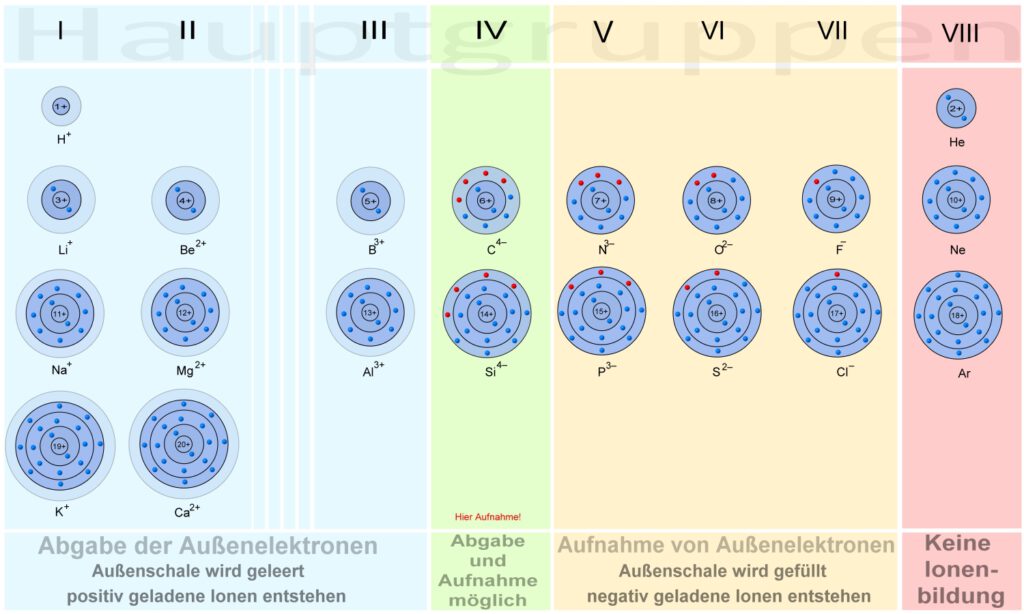
Allgemein kann man feststellen, dass die Elemente mit wenig Außenelektronen dazu neigen, ihre Außenelektronen abzugeben. Elemente bei denen die Außenschale zu mehr als der Hälfte gefüllt ist, nehmen bevorzugt Elektronen auf.
Hauptgruppen 1 bis 3 … Elektronenabgabe
Hauptgruppen 5 bis 7 … Elektronenaufnahme
Die Elemente der 4. Hauptgruppe gehen beide Wege, je nachdem welcher Reaktionspartner zur Verfügung steht.
Die Edelgase (8. Hauptgruppe) bilden keine Ionen auf natürliche Weise!
![]()
Stoffe und ihre Eigenschaften
Jede Substanz – in der Chemie „Stoff“ genannt – besitzt typische Merkmale (Eigenschaften), die sie einzigartig machen. Sie wird dadurch von anderen Stoffen unterscheidbar. In der Chemie wird immer nach einem gut „geeigneten Stoff“ gesucht, der besondere Bedingungen erfüllt und sich so optimal verwenden lässt. Jede Eigenschaft ermöglicht Verwendungen und jede Verwendung ist auf Eigenschaften zurückführbar.

Manche Stoffe finden als Medikament Verwendung, weil sie in unserem Körper einen Prozess stören oder verändern. Aspirin verdünnt das Blut, es fließt leichter. Man fand heraus, das hat fiebersenkende Wirkung. Holz brennt. Das liefert Wärme. Verrückt!
Arbeitsblätter: Was der Chemiker untersucht…
Stoffe—Stoffe sind unterscheidbar
Manche Stoffe lassen sich im Wasser so fein verteilen, dass sie für das menschliche Auge „unsichtbar“ werden. Sie lösen sich in Wasser auf.
Der Aggregatzustand
Wie die kleinsten Teilchen (Atome – Ionen – Moleküle ) zusammenhalten und für alle uns sichtbar als Feststoff oder als Flüssigkeit erscheinen, beschreibt der Aggregatzustand eines Stoffes. Halten die Teilchen fest zusammen, so bilden sie einen festen Stoff. Aber es genügt schon eine leichte Erwärmung, dann beginnen die Teilchen zu schwingen und sich zu bewegen. Die Ordnung zerfällt, es entsteht eine Flüssigkeit. Bei weiterer Erwärmung kann es sogar zur völligen Bewegungsfreiheit der Teilchen kommen, dem Gaszustand, dabei rasen die Teilchen wild umher.

Aggregatzustand A4 quer —- leer
liveworksheets.com
Die physikalischen Eigenschaften – Tafelwerkwerte
Die Dichte eines Stoffes oder die Temperaturen, bei denen Stoffe schmelzen oder sieden, kann man im Tafelwerk einsehen, da seit langer Zeit viele fleißige Menschen diese Daten bestimmt und gesammelt haben. Diese messbaren Daten nennt man die physikalischen Eigenschaften von Stoffen.
physikalische Eigenschaften —-Tafelwerk, Tabellen und Formeln
![]()